
Articulo original
Original article
35 (2) | Jul - Dic, 2025
Facultad de Ciencias Exactas y Naturales y Agrimensura (UNNE)
Open Access: https://revistas.unne.edu.ar/index.php/fce
E-mail: revistafacena@exa.unne.edu.ar
Polen fósil con afinidad a Alismataceae, Formación Palo Pintado, Mioceno de argentina
Fossil pollen with affinity to Alismataceae, Palo Pintado formation, Miocene of Argentina.
Mautino, Lilia René * 1 2 , Farrell, Ezequiel Eduardo 1 2 & Palazzesi, Luis 3
1. Centro de Ecología Aplicada del Litoral, Consejo Nacional de Investigaciones Científicas y Técnicas, y Universidad Nacional del Nordeste (CECOAL, CONICET-UNNE). Corrientes Capital, Argentina.
2. Facultad de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste (FaCENA-UNNE). Corrientes Capital, Argentina.
3. Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” (MACN-CONICET). Ciudad Autónoma de Buenos Aires, Argentina..
* Autor de correspodencia: liliamautino@yahoo.com.ar
Recibido/Received: 12 Marzo, 2025 | Aceptado/Acepted: 27 de Sept., 2025 | Publicado/Published: 19 de Diciembre, 2025.
Como citar este artículo: Mautino, L. R., Farrell, E. E. & Palazzesi, L. (2025). Polen fósil con afinidad a Alismataceae, formación palo pintado, mioceno de argentina. Revista FACENA 35(2), 186-222. Doi: https://doi.org/10.30972/fac.3528845
Resumen: Se describen granos de polen fósil con afinidad a la familia Alismataceae (géneros Echinodorus, Helanthium y Sagittaria) provenientes de la Formación Palo Pintado (Mioceno) en el noroeste de Argentina. Dos especies asignadas al género Punctioratipollis (P. sp.1 y P. sp. 2) exhiben rasgos morfológicos que permiten vincularlas con dichos géneros, constituyendo los primeros registros palinológicos de estas plantas en el Neógeno de Argentina. Su presencia, junto con macrofósiles previamente atribuidos a Sagittaria, indica el desarrollo de vegetación acuática dulceacuícola y/o palustre en ambientes de planicie de inundación con sistemas de ríos anastomosados. Mediante comparaciones con especies actuales, se constatan similitudes en las características aperturales y en la ornamentación de la exina, lo que respalda su asignación a Alismataceae. Estos hallazgos refuerzan la hipótesis de un origen sudamericano para Echinodorus y Sagittaria, con posteriores eventos de dispersión hacia Norteamérica, en concordancia con datos moleculares y evidencias macrofósiles. El presente aporte enriquece el conocimiento paleoflorístico de la Formación Palo Pintado y contribuye a la comprensión de la evolución de comunidades acuáticas en latitudes australes durante el Mioceno.
Palabras claves: Polen fósil; Alismataceae; Mioceno; Argentina.
Abstract: This study describes fossil pollen with affinity to the Alismataceae family (Echinodorus, Helanthium and Sagittaria genera) from the Miocene Palo Pintado Formation in northwestern Argentina. Two species assigned to the genus Punctioratipollis (P. sp.1 and P. sp. 2) display morphological features linking them to Echinodorus and Sagittaria, representing the first palynological records of these taxa in the Neogene of Argentina. Their presence, alongside macrofossils previously attributed to Sagittaria, suggests the development of freshwater aquatic and/or marsh vegetation in floodplain settings with anastomosing river systems. Comparative analyses with extant species show notable similarities in aperture characteristics and exine ornamentation, thus supporting their assignment to Alismataceae. These findings strengthen the hypothesis of a South American origin for Echinodorus and Sagittaria, followed by dispersal events toward North America, consistent with molecular data and macrofossil evidence. Overall, this work enhances our understanding of the paleofloristic diversity in the Palo Pintado Formation and contributes to broader insights into the evolution of aquatic plant communities in southern latitudes during the Miocene.
Keywords: Fossil pollen; Alismataceae; Miocene; Argentina.
Introducción
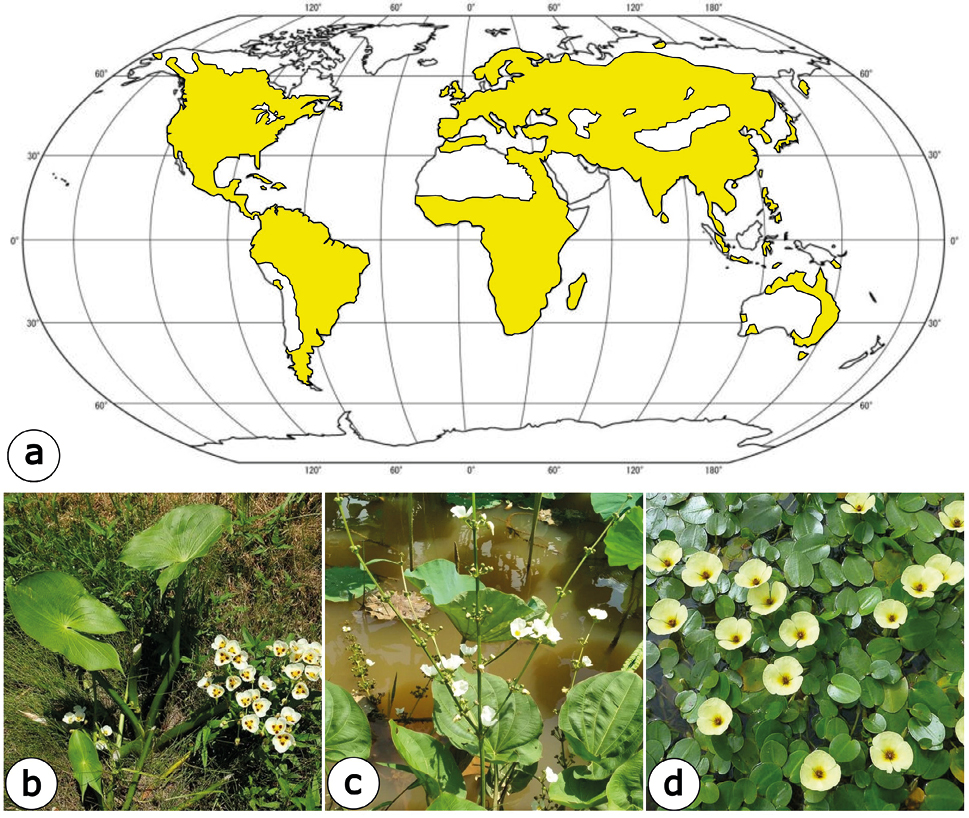
Figura 1. a. Planisferio con la distribución actual de la familia Alismataceae. Modificado de Stevens (2021). b) Porte y ambiente de Sagittaria montevidensis. c. Echinodorus grandiflorus. d. Hydrocleys nymphoides.
Las Alismataceae conforman una familia de angiospermas, monocotiledóneas de amplia distribución mundial, subcosmopolitas, constituídas por aproximadamente 16 y 90 especies (Stevens, 2021). Se halla bien representada en las zonas cálidas, en comunidades litorales, ribereñas, tierras bajas y/o humedales de cuerpos de agua lénticos o lóticos y terrenos inundados. Son plantas herbáceas, acuáticas o semiacuáticas con hojas erectas o flotantes, o palustres (Tur, 2008; Chen et al., 2012; Stevens, 2021; Lehtonen, 2018; Li et al., 2022) (Figura 1).
En Argentina, la familia está representada por 6 géneros: Echinodorus Rich., Helanthium (Benth. y Hook.f.) Engelm. ex J. G. Sm., Hydrocleys Rich., Limnocharis Bonpl., Sagittaria L. y Alisma L. Solamente los primeros tienen especies nativas en nuestro país, dado que Alisma con una sola especie en Argentina, A. plantago- aquatica L., es adventicia en la provincia de Río Negro (Anton y Zuloaga, 2021).
Echinodorus reúne aproximadamente 27-45 especies, distribuidas desde los Estados Unidos hasta la Argentina. En nuestro país se cuentan 9 especies y en la zona de estudio crece E. grandiflorus (Anton y Zuloaga, 2021). La mayoría de las especies del género Echinodorus son encontradas en regiones tropicales de Sudamérica, la cual es considerada como el centro de diversidad del género (Haynes y Holm-Nielsen, 1994).
Helanthium comprende tres especies, distribuídas desde los Estados Unidos hasta la Argentina, una nativa de la zona de islas del Caribe y dos son nativas de Sudamérica, presentes en Argentina: H. bolivianum (Rusby) Lehtonen y Myllys (Corrientes, Misiones y Santa Fe) y H. tenellum (Mart.) Britton (Corrientes) (Anton y Zuloaga, 2021; GBIF.org.).
Sagittaria comprende 25-35 especies, en su mayoría con distribución americana (desde Canadá hasta Chile y Argentina), unas pocas crecen en Europa y Asia. Al considerar las especies americanas, tres de ellas llegan hasta la Argentina: S. guayanensis Kunth, S. montevidensis Cham. et Schltdl. y S. rhombifolia Cham. (Tur, 2008; Canalli y Bove, 2017). De las tres, la única que habita en la región (Salta y Jujuy) es S. montevidensis, ya que S. guayanensis se encuentra en las provincias de Chaco, Corrientes, Formosa y Córdoba, finalmente S. rhombifolia crece, únicamente, en la provincia de Corrientes (Anton y Zuloaga, 2021).
A nivel mundial, el registro fósil de Alismataceae comienza en el Cretácico, aunque es escaso aquí y se extiende al Paleoceno con hojas, frutos, semillas, pecíolos y polen, procedentes de Norteamérica, Europa, Siberia y África (Muller, 1981; Friis et al. 2011; Chen et al., 2012; Coiffard y Mohr, 2018; Robledo et al., 2021). Sin embargo, actualmente no existe acuerdo de que todos estos fósiles, anteriores al Oligoceno, representen a Alismataceae (Muller, 1981; Chen et al., 2012; Robledo et al., 2021). Robledo et al. 2021, en la localidad de Quebrada del Estanque de la Formación Palo Pintado (estudiada también en este trabajo) hallaron aquenios con afinidad a Sagittaria montevidensis, considerados los primeros reportes de Alismataceae para el Neógeno de Sudamérica. Recientemente se han encontrado flores fósiles preservadas en ámbar, impresiones y compresiones, en el Oligoceno-Mioceno de México (Hernández-Sandoval et al., 2023). De este hallazgo se ha descrito un nuevo género: Nichima con dos especies Nichima magalloniae L. Hern., Cevallos‐Ferriz et Hernández‐Damián y Nichima gonzalez‐medranoi L. Hern., Cevallos‐Ferriz et Hernández‐Damián las que tienen afinidad botánica al clado Baldiella, Echinodorus y Alisma (Hernández-Sandoval et al., 2023). Estos autores coinciden con Friis et al. (2011) y señalan que son aceptados los frutos y semillas vinculados a Alismataceae que aparecen en Eoceno tardío a Oligoceno temprano en adelante.
Con respecto al polen asignado a la familia, en Cenozoico inferior se describe a Punctioratipollis ludwigii Krutzsch, especie tipo del género Punctioratipollis, relacionada botánicamente a Alismataceae, Polygonaceae o Ranunculaceae. Hay otros registros con afinidad a Alismataceae (Alisma) para el Oligoceno de Bélgica, Oligoceno tardío- Plioceno de Europa Central y Mioceno de EEUU (Daghlian, 1981; Muller, 1981). En el Paleógeno de México se registra polen afín a Sagittaria, aunque sólo se encuentra ilustrado (Martínez-Hernández y Ramírez-Arriaga, 1999). Para Sudamérica, el polen de Sagittaria ha sido registrado desde el Holoceno a la actualidad en numerosos trabajos, entre ellos en sedimentos de Argentina (Grill, 1997; Torres et al., 2022), Ecuador (Colinvaux et al., 1997), Bolivia (Burbridge et al., 2004), Brasil (Evaldt et al., 2013; Evaldt et al.2014, Mendez et al., 2021), Chile (Villagrán, 1991; Villagrán et al., 2004), Colombia (Hooghiemstra, 1984), Cuenca del Amazonas (Absy, 1985), entre otros. En sedimentos más antiguos, Mioceno-Plioceno y Pleistoceno de Amazonia (Brasil y Colombia) aparece polen afín a Sagittaria (D’Apolito et al., 2024) y a Sagittaria/Echinodorus (como Echiperiporites akanthos Hammen y Wymstra 1964) con algunas observaciones realizadas más abajo. En relación a Echinodorus existen además registros de polen en sedimentos del Holoceno de Argentina (Grill, 1997; Torres et al., 2022); Colombia (Hooghiemstra, 1984) y Brasil (Lehtonen, 2018; Evaldt et al., 2013 y 2014).
Por lo expuesto, para Sudamérica los registros de polen fósil con afinidad a Sagittaria y Echinodorus aparecen en sedimentos del Mioceno y en Pleistoceno-Holoceno. Para sedimentos del Neógeno de Argentina, los descritos en este trabajo constituyen los primeros palinomorfos afines a los géneros Echinodorus y Sagittaria.
El material palinológico deriva de la Formación Palo Pintado cuyo contenido paleontológico es vasto, la paleoflora hasta el momento dio cuenta de palinomorfos, hojas, maderas y frutos (Anzótegui y Cuadrado, 1996; Mautino, 2007; Horn, 2014; Garralla et al., 2016; Anzótegui et al., 2017 y 2019; Robledo, 2020; Mautino y Garralla, 2021). Las novedades del presente trabajo se dieron a conocer en un breve resumen en el marco de un simposio (Mautino et al., 2021). El paleoambiente ha sido interpretado como sistemas fluviales de ríos anastomosados de baja jerarquía y baja movilidad con bajo parámetro de sinuosidad, sección transversal somera y gran carga de lecho, desarrollados en una gran llanura de inundación (Galli et al., 2011; Galli et al., 2014). De acuerdo con esto, los taxones fósiles de este trabajo habrían integrado la vegetación acuática dulceacuícola y/o palustre acompañados por integrantes de otros linajes del mismo hábito (e.g., Cyperaceae, Haloragaceae, Pontederiaceae, Salviniaceae, Potamogetonaceae, Polygonaceae).
Procedencia estratigráfica y geográfica
La Formación Palo Pintado (Grupo Payogastilla) se encuentra al sur del Valle Calchaquí, en la provincia de Salta, entre los 25º41’01”S – 66º07’55”O y los 25º40’59”S – 66º05’49”O; y tiene una edad estimada entre los 10.29±0.11 Ma (K/Ar) y los 5.27±0.28 Ma (206Pb/238U) (Galli et al., 2008; Galli et al., 2011). Litológicamente está constituida por ciclos grano y estrato decrecientes de conglomerados soportados por matriz, areniscas cuarzosas y sublíticas limpias, medianas a finas, que culminan con niveles de pelitas verdes (Galli et al., 2011). Los palinomorfos de aquí presentan un buen estado de conservación y proceden de dos localidades fosilíferas de la Formación Palo Pintado: Quebrada del Estanque y Quebrada del Horno (Figura 2). En la columna estratigráfica general de la formación se ubican las muestras analizadas con palinomorfos (Figura 3).
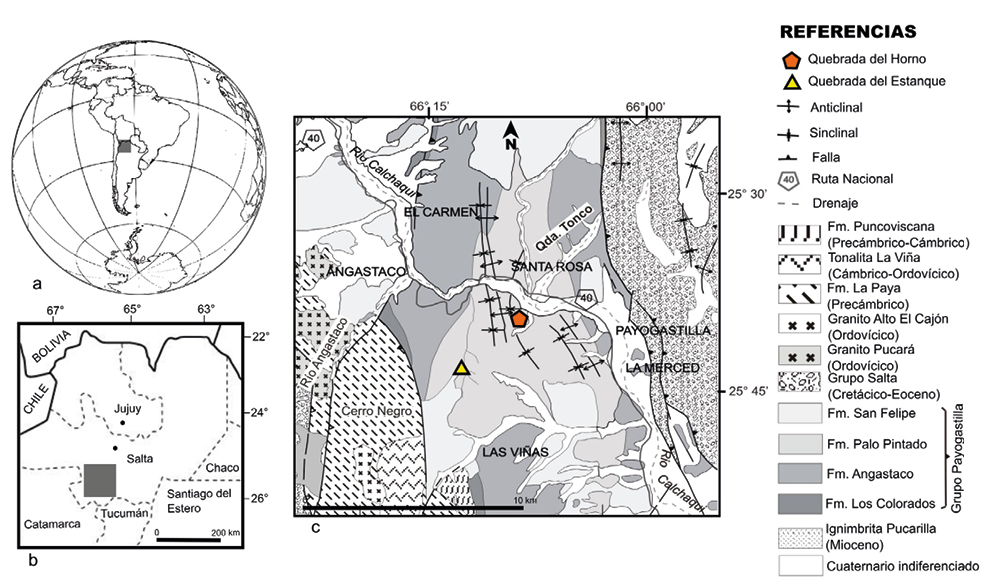
Figura 2. a y b. Ubicación geográfica de la zona de estudio en la provincia de Salta, Argentina. El cuadro gris delimita el área de estudio. c. Unidades estratigráficas en el Valle Calchaquí con las localidades estudiadas. Modificado de Galli et al. (2011).

Figura 3. Columna estratigráfica integrada de la Fm. Palo Pintado. Modificado de Galli et al. (2011). Las estrellas indican las muestras analizadas.
materiales y métodos
El material estudiado proviene de los niveles pelíticos de las dos localidades antes citadas en las cuales se han levantado sendos perfiles que abarcan los primeros 400 metros basales de la formación. Las muestras sedimentarias fueron tratadas en el Laboratorio de Preparación de Microfósiles (LaPMi) del CECOAL-CONICET-UNNE, siguiendo el método convencional para polen fósil que consiste en la separación de la materia orgánica de la inorgánica mediante los siguientes pasos: molido de 20 a 30 gramos de roca, ataque con ácido clorhídrico para la eliminación de carbonatos y fluorosilicatos, ataque con ácido fluorhídrico para eliminar silicatos y sucesivos filtrados con mallas (40, 25 y 10 µm), y finalmente se montaron en glicerina-gelatina. Para la observación y fotografiado de los palinomorfos se utilizó un microscopio óptico Leica DM500 con cámara fotográfica integrada ICC50 W. Los preparados señalados en Material estudiado, se indican, en cada taxón, con un número de colección y se detallan los registros de coordenadas (coordenada/coordenada). Los preparados microscópicos se encuentran en la “Colección Paleontológica de la Universidad Nacional del Nordeste, Dr. Rafael Herbst”, bajo el acrónimo Preparados Micropaleontógicos (CTES-PMP). Las afinidades botánicas se realizaron utilizando bibliografía y preparados de referencia procedentes de la Colección Palinológica de la Universidad Nacional del Nordeste Corrientes (PAL-CTES). La terminología adoptada es la sugerida por Hesse et al. (2009) y Punt et al. (2007). Con el fin de comparar las especies fósiles con las actuales se elaboró una tabla con especies de la familia Alismataceae: Echinodorus, Helanthium, Hydrocleys, Limnocharis y Sagittaria distribuidas actualmente en América del Sur (Tabla 1). Aunque, para las especies Helanthium bolivianum, Hydrocleys mattogrossensis, H. modesta y Limnocharis laforestii no se han encontrado datos de morfología palinológica. En la mencionada tabla se homogeniza la terminología, para lo cual se utiliza en el caso de la escultura el vocablo microequinada cuando la sexina posee microespinas supratectales (menores al micrón) y equinada cuando las espinas superan el micrón. Para revisar la sinonimia de las especies actuales de los géneros Echinodorus y Sagittaria; y además completar la distribución geográfica de los taxones incluidos en la Tabla 1, se consultaron dos bases de datos digitales: Flora Argentina y del Cono Sur: http://www.floraargentina.edu.ar/ (Anton y Zuloaga) y Global Biodiversity Information Facility: https://www.gbif.org/es/ (GBIF.org). Considerando que actualmente Echinodorus tenellus (Mart.) Buchenau es sinónimo de Helanthium tenellum (Mart). Britton, en el presente trabajo, cuando se citan registros fósiles de Echinodorus, y se realizan inferencias en el apartado discusión, se extiende esa interpretación a H. tenellum.
resultados
Paleontología sistemática
División: Pollenites Potonié, 1893
Subturma: Poliporinas Naumova emend. Potonié, 1960
Género Punctioratipollis Krutzsch 1966
Observaciones. Géneros periporados similares a Punctioratipollis son Periporopollenites Pflug y Thomson 1953, Liquidambarpollenites Raatz 1937 ex Potonié 1960 y Caryophyllidites Couper 1960. El género Periporopollenites Pflug y Thomson 1953 en Thomson y Pflug 1953 luego de la enmienda de Krutzsch en 1966 quedó restringido a formas similares a las de Punctioratipollis pero con exina microrreticulada y con ausencia de elementos positivos. Liquidambarpollenites fue publicado en forma inválida por Raatz en 1937 de acuerdo a Jansonius y Hill (1998) y correctamente validado por Potonié en 1960, no obstante, por principio de prioridad, este último quedaría como un sinónimo de Periporopollenites. Posteriormente, Stover y Partridge (1973) sinonimizan los géneros Liquidambarpollenites Raatz 1937 ex Potonié 1960 y Caryophyllidites Couper 1960 a Periporopollenites. Ibrahim et al. 2015 al realizar la diagnosis enmendada del género Cretacaeiporites Herngreen 1973, establece una nueva combinación: C. krutzschi (Boltenhagen 1975) utilizando una especie de Punctioratipollis (P. krutzschi como basónimo).
Por consiguiente, el género Punctioratipollis Krutzsch 1966 reúne granos apolares, periporados, subesferoidales. Poros redondeados con distribución irregular y con membrana apertural granulada a punteada. Exina delgada de 1 a 1,5 µm de espesor, con capa columelar visible pero delgada, equinada y con puntuaciones. El autor relaciona al género con las actuales familias: Polygonaceae, Alismataceae (Sagittaria) o Ranunculaceae.
El género Punctioratipollis extiende su registro fósil desde el Cenozoico inferior hasta el Mioceno en Europa y África (White, 2006).
Especie tipo: Punctioratipollis ludwigii Krutzsch 1966.
Figura 4, a-c
Descripción. Granos de polen de 20 a 24 µm de diámetro, pequeños a medianos, apolares, radiosimétricos, subesferoidales, pantoaperturados. Pantoporados a pantopor(oid)ados 10 a 18 poros a poroides de ± 3-4,5 µm de diámetro, de márgenes irregulares, con distribución al azar. Membrana apertural esculturada con microespinas que se disponen con menor densidad que el resto de la superficie del grano. Exina tectada de 0,7 a 1,2 µm de espesor, sexina y nexina de similares espesores, columelas bajas. Sexina finamente rugulada a escabrada, microequinada. Microespinas que se distribuyen al azar.
Observaciones. Las aperturas, si bien son subcirculares como un poro, tienen los bordes rasgados o discontinuos, y al microscopio se observan como poco marcados.
Material estudiado. CTES-PMP 1711a: 152,5/8,4; 147,3/ 8,2; 148/11,5; 142/8; 142/12,7. 1967: 22,4/138,3.
Comparaciones. Punctioratipollis sp. 1 comparte con la especie tipo P. ludwigii Krutzsch 1966 similares características generales, como ser el tamaño de los granos, la presencia de poros con membrana apertural esculturada y exina delgada con espinas. Sin embargo P. sp. 1 se diferencia porque posee un menor número de aperturas (hasta 18), de mayores diámetros (entre 3 a 4,5 µm) y la exina no es perforada; en contraste en P. ludwigii los poros pueden llegar a 30 y solo hasta 3 µm de diámetro.
P. sp.1 y P. aegypticus Kedves 1981 del Mioceno inferior de Egipto comparten similares tamaños del diámetro de los granos y de las aperturas, como así también número de estas últimas. A pesar de ello, P. sp. 1 se diferencia de P. aegypticus porque posee membrana apertural con microespinas y además exina rugulada, escabrada y con microespinas; en P. aegypticus es granulada, y punctada, respectivamente. Además, el espesor de la exina en P. aegypticus puede llegar a 1,6 µm (en P. sp. 1 solo a 1,2 µm) y la capa infratectal es la más gruesa de las capas de la exina.
Por otro lado, es necesario destacar que hay varios registros de la especie fósil Echiperiporites akanthos Hammen y Wymstra 1964 con afinidad botánica a los géneros actuales Sagittaria/Echinodorus (Salamanca Villegas et al.2016; Sá y Carvalho, 2017; D’Apolito et al. 2018). E. akanthos aparece en sedimentos del Mioceno, Plioceno y Pleistoceno de Amazonia occidental tanto en Brasil como en Colombia. La especie E. akanthos Hammen y Wijmstra 1964, en los trabajos antes mencionados, deberían ser revisados, “dado que posiblemente, en muchas ocasiones las formas periporadas y estefanoporadas, han sido mal asignadas por los palinólogos. A pesar de ello, es innegable que se observan formas de esa especie fósil que pueden asociarse tanto a Sagittaria como a Echinodorus” (comunicación personal, D’Apolito). D’Apolito et al. 2024 para la formación Solimões (Amazonia brasileña occidental) asigna a E. akhantos una afinidad botánica a Sagittaria.
Hay similitud de P. sp. 1 con el material ilustrado y descrito como Echinodorus grandiflorus en sedimentos del Holoceno de Brasil (fig. 37, Evaldt, 2013).
De acuerdo al análisis de los caracteres palinológicos realizado entre la especie fósil con especies de los géneros incluidos en la Tabla 1, se observa que los elementos esculturales característicos de las especies actuales de Sagittaria, son las espinas, microespinas y entre estas, un microrretículo (en algunos escabrado), los cuales no están presentes en los ejemplares fósiles descritos en P. sp. 1, excepto las microespinas. Sumado a esto, las aperturas en P. sp. 1 son bastante nítidas (como en Echinodorus) en contraste con Sagittaria las cuales son consideradas poroides (poco distinguibles) y por ende, difíciles de contar. Se concluye que P. sp.1 es afín al género actual Echinodorus.
Del análisis de la Tabla 1, al comparar la especie fósil P. sp. 1 con las actuales americanas del género Echinodorus, se desprende que existe coincidencia de aquella con todas las especies incluidas en el gráfico, al tener en cuenta los caracteres morfológicos como ser el tamaño de los granos, número y características de las aberturas. Si elegimos el primer carácter, en su gran mayoría las especies actuales son de tamaño pequeño, y otros medianos, en este último caso se mencionan a E. grandiflorus en Caccavari 1983, Cabrera 2021 y Salgado 2006; la especie E. longiscapus en Caccavari 1983; a la especie E. paniculatus en García Murcia et al. 2011, y E. uruguayensis en Caccavari 1983. Con respecto a las aperturas, hay una gran semejanza con todas las especies actuales que, si bien las describen de distintas maneras, algunas con poros y otras poroides, se puede inferir (imágenes) que en muchos casos tienen márgenes poco definidos, aún cuando se las describen como poradas. Es así que la especie E. cordifolius (Halbritter y Weis, 2021) está descrita con poros, aún así, de acuerdo a la ilustración podrían ser considerados poroides y el mismo caso se presenta en E. uruguayensis también en Halbritter (2021). Una situación semejante se exhibe en E. grandiflorus (Salgado, 2015) aunque la autora reconoce formas poradas también expresa que a veces no están bien diferenciadas estas aperturas. En contraste, García Murcia et al. (2011) se refiere a formas inaperturadas en E. paniculatus, en cambio en la ilustración (Lám.1, figs 2 a y b) se observan claramente los poros. Todas las especies de Echinodorus descritas en Caccavari (1983) poseen pseudo opérculo y márgenes irregulares o fimbriados (formados por fragmentos de la exina).
Con respecto al espesor de la exina, P. sp.1 es similar a todas las especies actuales consignadas en el cuadro, con excepción de E. grandiflorus, E. longiscapus, E. macrophyllus y E. uruguayensis que las superan (Caccavari, 1983). Si nos detenemos en la escultura, la presencia de microespinas supratectales en P. sp. 1 también es destacada en E. cordifolius, E. grandiflorus (excepto la descripta por Alves et al., 2021 y por Salgado, 2015, con espinas menores a 2 µm), E. longicapus, E. macrophyllus, E. quadricostatus y E. uruguayensis. Con respecto a los elementos esculturales que acompañan a las microespinas, hay variabilidad de aquellos, además algunas especies tienen el tectum perforado (carácter no discernible en el fósil). En E. longiscapus las báculas forman un infrarretículo o infrarrugulado amplio. Se observa además que, una misma especie, descrita por diferentes autores, puede ser considerada con distintas características en la exina como ser E. grandiflorus que en su mayoría la describen como escabrada, excepto Santos Alves et al. que observa gránulos. Esta variabilidad en los elementos esculturales, posiblemente radica en una interpretación disímil de dichos caracteres.
Al comparar la especie fósil con las especies actuales Helanthium tenellum, Hydrocleys nymphoides, H. martii y Limnocharis flava surge que Helanthium tenellum (Jerémié et al. 2001 y PAL-CTES N°1154) comparte con P. sp 1. diámetro y tamaño de los granos, características de la membrana apertural y de la exina. Hydrocleus nymphoides (Argue 1973, Caccavari 1983 y Chanda et al. 1988) tiene mayor diámetro de los granos y el número de los poros se solapan, aunque no superan los 11 en la especie actual. El espesor de la exina es mayor y la escultura es equinada con gránulos. De la comparación con H. martii (Chanda et al. 1988) surge que, con las formas fósiles de aquí, tienen en común el número de poros (aunque en P. sp. 1 pueden llegar a 18) y diámetro de los mismos. La membrana apertural en la especie actual es granulada en cambio en la fósil tiene microespinas. La exina de la especie actual es ligeramente de mayor espesor (hasta 1,5 µm).
Del contraste de P. sp. 1 con L. flava (Alves et al. 2021, Argue 1973 y Chanda et al. 1988) surge que comparten tamaño general de los granos, aunque los fósiles son un poco más chicos (hasta 24 µm). La especie actual tiene menor número de aperturas con membranas que constan de islotes y canales en la exina además de mayor espesor de la exina y escultura granulada.
Afinidad botánica. Echinodorus spp. y Helanthium tenellum.
Ecología. Herbáceas, acuáticas, viven en zonas muy húmedas e inundables comunes en pajonales y arroyos.
Punctioratipollis sp. 2
Figura 4, d-f
Descripción. Granos de polen de 17 a 29 µm de diámetro, pequeños a medianos, apolares radiométricos, subesferoidales. Pantopor(oid)ados, 12 a 15 poroides de 2 a 5 µm diámetro de forma irregular con contornos poco marcados, ubicados en zonas algo deprimidas de la exina. Distribución al azar. Membrana apertural presente. Exina de 0,9 a 1,2 µm de espesor, exina estratificada, sexina y nexina de similares espesores, columelas bajas. Tectum equinado con escultura variable. Microespinas y espinas, microespinas desde 0,8 a 1 y espinas de 1 a 1,8 alto espaciadas entre sí, entre las espinas la exina es infrarreticulada a escabrada.
Observaciones. Las aperturas son muy difíciles de observar, dado que son poco marcadas. Por lo cual, en general, solo son detectadas en corte óptico, consideradas en algunos casos como imperceptibles.
Material estudiado: CTES-PMP 2034d:142,5/15,8; 137/16,2; 2034a: 128/25; 1993a: 15,4-153,6; 140/11,4; 3715a: 144/17,5.
Comentarios. El escaso material impide la creación de un nuevo taxón.
Comparaciones. P. sp. 2 comparte con P. ludwigii una apariencia similar por la presencia de poros, con membrana apertural esculturada y exina delgada con espinas. Sin embargo, son diferentes porque P. sp.2 tiene mayor diámetro general de los granos (hasta 29µm), aperturas que son poroides y en menor número (12-15), exina con micro espinas, espinas y microretículo-escabrado y ausencia de perforaciones.
P. sp. 1 se diferencia de P. sp. 2 principalmente en las aperturas y escultura. Con respecto al primer carácter, P. sp. 2 consta claramente de poroides sin embargo en P. sp. 1 las aperturas son más marcadas, considerándose poros a poroides. La escultura en P. sp. 2 está constituida por microespinas, espinas y entre ellas un microretículo o escabrado. En cambio P. sp. 1 cuenta con microespinas entre las cuales se ubica un rugulado-escabrado. Ambos taxones presentan similares tamaños en el diámetro de los granos (desde pequeños a medianos) y membrana apertural esculturada.
P. sp. 2 y P. aegypticus Kedves 1981 (Mioceno inferior de Egipto) comparten el tamaño de los granos, el número y diámetro de las aperturas; en contraste, las diferencias residen en la exina. P. aegypticus tiene mayor espesor (hasta 1,6µm) con capa infratectal más gruesa, y el tectum es puntado. En P. sp. 2 el tectum es equinado, con microespinas y espinas, además la presencia de un infrarreticulo a escabrado entre los elementos supratectales.
Para América aparecen registros de polen afines a Alismataceae aunque son escasos. Algunos de ellos fueron discutidos anteriormente (como E. akanthos) y otros solamente se citan aunque no están descritos. Es así que, se encontraron granos de polen asignados a Sagittaria sp., en el Eoceno-Oligoceno (Paleógeno tardío) de Tepexi de Rodríguez, Puebla, México (Martínez-Hernández y Ramírez-Arriaga, 1999) que están ilustrados (Fig. 42) pero no descriptos, aun así, muestran semejanzas al material de aquí. También se registra polen asignado a Sagittaria en el Mioceno de Brasil (D’Apolito et al. 2024). Ya en el Holoceno, como se expresó en Introducción, son más frecuentes; es así que los ejemplares incluidos en P. sp. 2 resultan similares a aquellos descritos e ilustrados como Sagittaria en Absy, 1985 (Lám. VI, fig. 82), como así también a S. montevidensis en Evaldt et al., 2013 (Fig. 38).
P. sp. 2 resulta similar a los palinomorfos del Holoceno descritos e ilustrados como Sagittaria sp. (Lam. 5, fig. 82 en Absy, 1985) para la Cuenca del Amazonas; y a Sagittaria montevidensis Fig. 28 descrita e ilustrada en Evaldt et al. 2013 para Brasil.
Para Argentina se menciona polen del tipo Alismataceae en Paso Otero para el Pleistoceno-Holoceno (Gutiérrez et al., 2011), sin embargo este registro carece de descripción y de ilustración, lo que impide otro tipo de comparación.
Al contrastar P. sp. 2 con las especies actuales sudamericanas del género Sagittaria surge que la especie fósil de aquí tiene similitudes en tamaño general de los granos con S. lancifolia (en Ybert et al. 2017, y Roubik y Moreno 1991), S. montevidensis subsp. montevidensis (en Caccavari 1983), S. montevidensis (con todas las incluidas en la tabla excepto las de Bauermann et al. 2013 y Radaeski et al. 2014) y S. tipo sagittifolia. En cambio resultan con diámetros mayores S. guayanensis y S. lancifolia (en García Murcia et al. 2011). De todas las especies comparadas, considerando el tipo y número de aperturas y sus características, la especie fósil guarda mayor similitud con S. montevidensis y S. montevidensis subs. montevidensis. Esta especie es descrita por Caccavari (1983) con poros aunque destaca que son fimbriados (bordes rasgados), y sin estructura; sumado a ello Wodehouse (1936) la describe con “poros difíciles de contar”. Las demás especies de Sagittaria incluidas en la tabla también guardan cierta similitud con la especie fósil, en el caso de S. guayanensis y S. lancifolia, que García Murcia et al. 2011 describen como inaperturadas, es necesario destacar que realmente no pueden observarse las aperturas. Estas apreciaciones revelan que estos materiales deberían revisarse en corte óptico o con tinción para identificarlas, denotando lo difíciles que son para contarlas.
Ybert et al. (2017) reconocen en la especie S. lancifolia, la presencia de poroides, por lo tanto, se puede deducir que una misma especie descrita por diferentes palinólogos, hacen distintas interpretaciones de un mismo carácter.
En el presente trabajo, tanto las dos especies fósiles como las actuales de Echinodorus y Sagittaria (PAL-CTES) son descritas con poroides, de acuerdo a Punt et al. (2007) y Hesse et al. (2009) los cuales consignan que son aperturas más o menos similares a un poro, circulares o elongadas con márgenes poco definidos o poco perceptibles.
Todas las especies de la Tabla 1 muestran en su ilustración la preservación de la membrana apertural esculturada (a veces no descrita) carácter constante en los granos fósiles y actuales de Sagittaria.
Con respecto a la exina de P. sp. 2 que es tectada y sus características de espesor son coincidentes con todas las incluidas en el la Tabla 1, excepto S. guayanensis, S. montevidensis (PAL-CTES y en Salgado 2015), y S. tipo sagittifolia, que las superan ligeramente en espesor. Los caracteres esculturales de las especies de Sagittaria, son los más variables entre todos. La escultura de P. sp. 2 tiene semejanzas con las descritas en S. montevidensis y S. montevidensis subsp. montevidensis por la presencia de microespinas, espinas y un tectum infrarugulado a rugulado entre los elementos positivos supratectales. A pesar de ello hay especies solamente microequinadas como S. guayanensis, S. lancifolia, y S. montevidensis en Pasarelli y Cortés 2017.
Afinidad botánica: Alismataceae, género Sagittaria montevidensis.
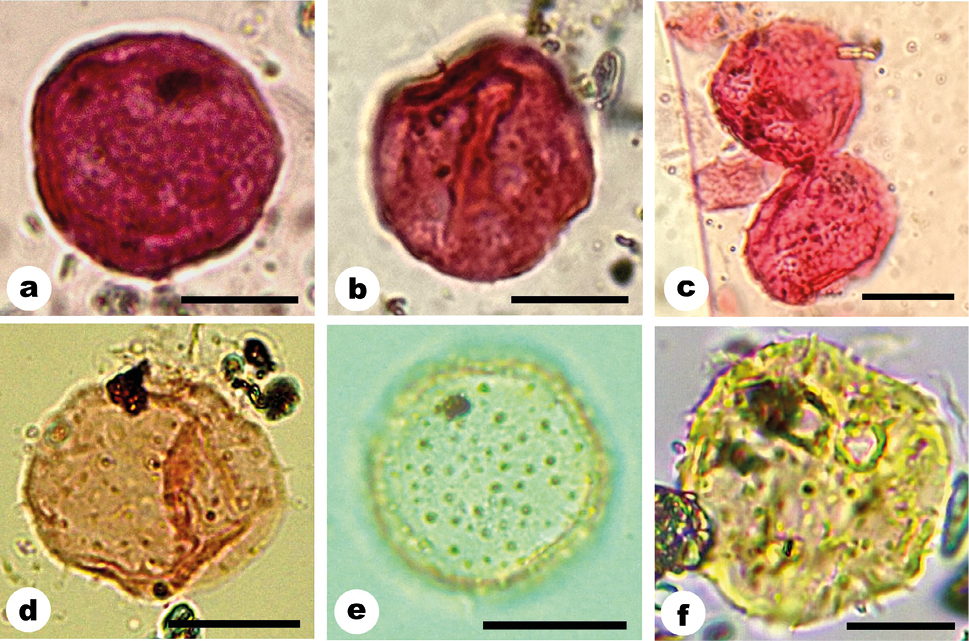
Figura 4. a-c. Punctioratipollis sp. 1: a 1711a: 152/8,4; b. 1711a: 148/11,5; c. 1711a: 142/8. d-f. Punctioratipollis sp. 2: d. 2034d: 142,15/15,8; e. 1993: 153,6/15,4; f. 3715a: 144/17,5. La escala equivale a 10 µm.
Tabla 1. Comparación entre las especies fósiles Punctioratipollis sp. 1 y Punctioratipollis sp. 2 con especies actuales americanas de los géneros Echinodorus, Helanthium, Hydrocleys, Limnocharis y Sagittaria. Las especies actuales se presentan en orden alfabético. Abreviaturas: en estructura de la exina: T (exina tectada); I (intectada). En distribución geográfica: *Anton y Zuloaga (2021) **GBIF.org (https://www.gbif.org).
DISCUSIÓN
Los nuevos hallazgos de polen fósil con afinidad a Alismataceae en la Formación Palo Pintado (Mioceno, provincia de Salta, Argentina) representan una contribución significativa para la comprensión de la historia evolutiva y la distribución paleobiogeográfica de esta familia en Sudamérica. Hasta ahora, los registros palinológicos de Echinodorus (incluyendo Helanthium, ver comentario en materiales y métodos) y Sagittaria en América del Sur se concentraban en depósitos miocénicos, cuaternarios y, en ocasiones, en el Pleistoceno tardío; por lo tanto, su presencia en sedimentos del Neógeno argentino constituye una evidencia novedosa. Este aspecto cobra relevancia si se considera que la familia Alismataceae está integrada por especies predominantemente acuáticas o semiacuáticas, con hábitats asociados a ambientes ribereños, humedales o cuerpos de agua someros. Así, el reconocimiento de estos taxones en un contexto de ríos anastomosados, como el de la Formación Palo Pintado, ilustra la diversificación y adaptación de plantas acuáticas durante el Mioceno en una región que en la actualidad exhibe condiciones ambientales diferentes.
Desde una perspectiva palino-taxonómica, la asignación de los granos fósiles al género Punctioratipollis confirma la complejidad de interpretar el registro polínico en grupos con aperturas difusas y ornamentaciones finas. En especial, la distinción entre caracteres propios de Echinodorus y de Sagittaria ha resultado históricamente problemática, pues en ambos géneros se presentan poros o poroides de márgenes irregulares, con membranas aperturales esculturadas y elementos supratectales (microespinas, espinas o gránulos). Los autores que se han ocupado de estudiar el polen de estas dos monocotiledóneas (p. ej., Caccavari, 1983; Wodehouse, 1936; Punt y Reumer, 1981) destacan la variabilidad intraespecífica y la dificultad de delimitar con precisión los rasgos aperturales. De hecho, el material fósil asignado aquí a Punctioratipollis sp. 1 muestra aperturas más definidas, compatibles con la morfología observada en especies actuales de Echinodorus; mientras que Punctioratipollis sp. 2 presenta una combinación de espinas de diversos tamaños y poroides mal definidos, recordando las condiciones de Sagittaria montevidensis.
De igual manera, la confirmación de que P. sp. 1 se correlaciona más sólidamente con Echinodorus que con Sagittaria apoya la hipótesis de que, en la morfología polínica de las Alismataceae, existen rasgos distintivos que se habían pasado por alto en trabajos anteriores. Aunque ambos géneros presentan poros no siempre bien definidos (poros a poroides), la membrana apertural de Echinodorus tiende a ser algo más evidente y, a menudo, contiene microespinas con distribución al azar sobre la exina. Por otro lado, los ejemplares de Sagittaria muestran espinas supratectales combinadas con microespinas y, en ocasiones, un microrretículo, lo cual coincide con la ornamentación vista en Punctioratipollis sp. 2.
En términos paleoambientales, los sedimentos de la Formación Palo Pintado se han interpretado como sistemas de ríos anastomosados con bajo parámetro de sinuosidad y grandes llanuras de inundación, un escenario propicio para el desarrollo de vegetación palustre y acuática (Galli et al., 2008; Galli et al., 2011). La asociación polínica de la misma unidad incluye, además de Alismataceae, a otros linajes con preferencias ecológicas similares, como Cyperaceae, Haloragaceae, Pontederiaceae y Potamogetonaceae, lo que refuerza la idea de un paisaje donde abundaban cuerpos de agua someros y zonas húmedas durante el Mioceno tardío. Esta confluencia de familias acuáticas indica, asimismo, que los parámetros climáticos habrían sido más benignos que en la actualidad para el noroeste argentino, consistente con otras evidencias paleontológicas (Robledo et al., 2020, 2021).
Otro aspecto relevante es el sustento que aportan estos hallazgos a la hipótesis de un origen sudamericano tanto para Echinodorus como para Sagittaria, o al menos para ciertas líneas dentro de los clados. Estudios filogenéticos moleculares (Chen et al., 2012; Ito et al., 2020) sugieren que las Alismataceae se habrían originado en el Cretácico tardío, con una posterior dispersión a lo largo del Terciario, en parte favorecida por puentes terrestres y conexiones entre continentes. En este sentido, el registro fósil del género Sagittaria en la propia Formación Palo Pintado —reportado como macrofósiles (aquenios) por Robledo et al. (2021)— coincide ahora con la presencia de polen afín a S. montevidensis, reforzando la idea de que el grupo ya se encontraba en plena diversificación en el Mioceno tardío. Para Echinodorus, la evidencia fósil aquí discutida proporciona un nuevo punto de referencia temporal y espacial, lo que permitiría trazar rutas dispersivas más claras hacia las latitudes tropicales y templadas de América.
La aparente escasez de registros fósiles más antiguos de Alismataceae podría explicarse por la fragilidad del material y las condiciones tafonómicas necesarias para su preservación. No obstante, diversos autores han cuestionado la verdadera asignación de ejemplares del Cretácico y Paleógeno temprano a la familia (Muller, 1981; Chen et al., 2012). Esto muestra que, si bien existen indicios de la presencia ancestral de Alismataceae, es crucial validar cada nuevo registro mediante comparaciones detalladas con la variabilidad observada en taxones actuales. En el caso concreto de la Formación Palo Pintado, el estado de conservación de los granos de polen ha facilitado su estudio morfológico, revelando detalles de la exina, el espesor y la distribución de microespinas o espinas, y la disposición de los poros. Estas características hacen posible distinguir entre distintas afinidades y brindar un panorama más completo de la comunidad palustre local.
En cuanto a las implicaciones ecológicas de estos registros fósiles, la presencia de Echinodorus y Sagittaria indica ambientes de agua dulce con inundaciones periódicas, donde las plantas herbáceas acuáticas o semiacuáticas encontraban condiciones favorables de luz, nutrientes y sustrato. El paralelismo con comunidades modernas de la misma familia, generalmente asociadas a humedales, charcas estacionales o márgenes de ríos, refuerza esta interpretación. Asimismo, la coexistencia de polen de Alismataceae con otros palinomorfos de familias acuáticas (p. ej., Pontederiaceae, Hydrocharitaceae, Typhaceae) sugiere la existencia de ensambles vegetales complejos y bien desarrollados en los márgenes de las paleocorrientes, lo que posiblemente implicaba una oferta alimenticia y de hábitat para fauna asociada (invertebrados acuáticos, peces y vertebrados que dependían de humedales).
Finalmente, la discusión sobre las vías de dispersión y el intercambio florístico queda abierta. Chen et al. (2013) proponen que Echinodorus se originó en Sudamérica para luego expandirse a regiones septentrionales, mientras que la historia de Sagittaria habría involucrado intercambios con África. Sin embargo, los datos de Ito et al. (2020) matizan esta visión, sugiriendo un posible origen sudamericano para Sagittaria, el cual hoy se ve refrendado por el hallazgo en la Formación Palo Pintado. Esta aparente convergencia de líneas de evidencia —molecular, macrofósil y palinológica— resalta la importancia de la investigación multidisciplinaria para dilucidar la evolución de las monocotiledóneas acuáticas. A medida que se recuperen más datos de otras regiones de Sudamérica y del hemisferio sur, será posible afinar los modelos biogeográficos y las estimaciones temporales de divergencia en Alismataceae.
En síntesis, los registros polínicos de Punctioratipollis sp. 1 (afín a Echinodorus spp. y Helanthium tenellum) y Punctioratipollis sp. 2 (afín a Sagittaria montevidensis) subrayan la diversidad vegetal del Mioceno tardío en el noroeste argentino y refuerzan la relevancia paleontológica de la Formación Palo Pintado. La concordancia de estos datos con macrofósiles de aquenios de Sagittaria y con análisis previos de palinomorfos acuáticos amplía el panorama paleoecológico, revelando hábitats húmedos y un clima relativamente más cálido e inestable de lo que se registra hoy día en esa latitud. Además, la discusión en torno al estatus de otras formas fósiles cuestiona clasificaciones previas y pone de relieve la necesidad de revisiones críticas y comparaciones detalladas con floras modernas. Desde la perspectiva evolutiva, este descubrimiento da sustento a la idea de que Alismataceae ya estaba establecida y diversificada en el Mioceno de Sudamérica, alineándose con hipótesis filogenéticas que proponen un origen y subsecuente dispersión continental de Echinodorus y Sagittaria. Como conclusión más amplia, la combinación de evidencia palinológica, macrofósil y molecular constituye una vía prometedora para refinar el conocimiento acerca de la radiación de las monocotiledóneas acuáticas y su influencia en las paleoecologías regionales durante el Cenozoico.
Contribuciones de los autores
El registro fósil de la familia Alismataceae y en especial de palinomorfos es bastante escaso, además no hay muchas certezas con algunos de ellos, en particular los anteriores al Oligoceno. Del análisis del material fósil y de su comparación con especies actuales, se reconoce que entre los ejemplares vinculados a Echinodorus y Sagittaria, existen diferencias palinológicas, si bien algunos caracteres pueden ser compartidos.
En esta contribución se describen e ilustran a Punctioratipollis sp. 1 y a Punctioratipollis sp. 2 registrados de las localidades Quebrada del Estanque y Quebrada del Horno, Formación Palo Pintado. La importancia del trabajo radica en que las especies fósiles, derivadas de la mencionada formación constituyen los primeros palinomorfos para el Mioceno de Argentina afines a los géneros Echinodorus spp., Helanthium tenellum y Sagittaria montevidensis. Estos hallazgos de polen siguen incrementando la diversidad paleoflorística de la Formación Palo Pintado y además constituyen evidencia que apoya un origen sudamericano de los géneros Echinodorus y Sagittaria. De acuerdo a la afinidad botánica y a los ambientes de los afines actuales, los fósiles habrían integrado la vegetación acuática dulceacuícola y/o palustre acompañados por integrantes de otros linajes del mismo hábito e.g. Corsinipollenites exinitenuis (Onagraceae), Glencopollis sp. (Polygonaceae), Sparganiacepollenites spp. (Sparganiaceae-Typhaceae), Parihiatus aquaticus (Pontederiaceae); Smilacipites aquaticus (Hydrocharitaceae); Potamogetonaceaepites spp. (Potamogetonaceae), Haloragacidites myriophylloides (Haloragaceae), entre otros.
AGRADECIMIENTOS
Este trabajo está dedicado a la memoria de la técnica de laboratorio Eva Acevedo quien ha preparado las muestras palinológicas que sirvieron para el presente artículo, además a los Dres. Luisa Anzótegui y Rafael Herbst por su trayectoria profesional. Los autores agradecen a los árbitros por sus valiosas sugerencias que mejoraron el manuscrito del presente trabajo y a la Srta. Luciana René Pasetto por la colaboración con la obtención de fotos. Fue financiado por el Proyecto Paleocomunidades del Neopaleozoico, Mesozoico y Neógeno del Cono Sur de Sudamérica de la Secretaría General de Ciencia y Técnica UNNE. PI 22F024, en el marco del Grupo de Investigación: Paleoflora del Neopaleozoico, Mesozoico y Paleontología del Neógeno de América del Sur.
Contribuciones de los autores
Conceptualización e investigación. L.R. M, E. F. y L. P.
Confección de láminas y figuras. E. F.
Todos los autores han revisado el manuscrito.
Absy, M. L. (1985). A palynological study of Holocene sediments in the Amazon basin. [Tesis Doctoral].
Alves, J. S., Costa, K. de M. y Leite, A. V. de L. (2021). O uso da Palinologia na descrição de espécies: morfología polínica e Polinizadores de Alismataceae Vent. Diversitas Journal, 6 (3), 3115-3132.
Anton, A., M. y Zuloaga, F. O. (2 de marzo 2021). Alismataceae. Flora Argentina y del Conosur. http://www.floraargentina.edu.ar.
Anzótegui, L. M. y Cuadrado, G. (1996). Palinología de la Formación Palo Pintado, Mioceno Superior, provincia de Salta, República Argentina. Parte 1. Taxones nuevos. Revista Española de Micropaleontología, 28, 77-92.
Anzótegui, L. M., Mautino, L. R., Garralla, S. S., Herbst, R., Robledo, J. M. y Horn, M. Y. (2017). Paleovegetación cenozoica del Noroeste Argentino. En Muruaga, C. y Grosse, P. (Eds.), Ciencias de la Tierra y Recursos Naturales del NOA, Relatorio del Congreso Geológico Argentino, (Vol. 20, pp. 767–781). Asociación Geológica Argentina.
Anzótegui, L. M., Mautino, L. R., Horn, Y. M., Garralla, S. S. y Robledo, J. M. (2019). Paleovegetación del Mioceno tardío del Noroeste de Argentina. Opera Lilloana, 52, 109–130.
Argue, C. L. (1973). The Pollen of Limnocharis Flava Buch., Hydrocleis Nymphoides (Willd.) Buch., and Tenagocharis latifolia (Don) Buch. (Limnocharitaceae). Grana, 13 (2), 108-112. https://doi.org/10.1080/00173137309429885
Basilio, A. M. (1996). Polen de las especies hidrófitas en las mieles del delta del Rio Paraná Paraná (Argentina). Boletín de la Sociedad Argentina de Botánica, 31 (3-4), 231-234.
Bauerman Girardi S., Nunes Radaeski, J., Cardoso Pacheco Evaldt, A. Pereira Queiroz, E. Mourelle D., Prieto, A. R., y da Silva Claudia Ines. (2013). Pólen. Nas Angiospermas Diversidade e evolucao. Editora da ULBRA.
Boltenhagen, E. (1975). Pollen périporé du Crétacé supérieur du Gabon. Revue de Micropaléontologie, 17 (4), 164-170.
Burbridge, R. E., Mayle, F. E. y Killeen, T. J. (2004). Fifty-thousand-year vegetation and climate history of Noel Kempff Mercado National Park, Bolivian Amazon. Quaternary Research, 6, 215-230.
Cabrera, M. M. (2021). Identidad de las mieles de la región nordeste del Distrito Oriental del Parque Chaqueño [Tesis Doctoral].
Caccavari de Filice, M. (1983). Polen de Alismataceae y Butomaceae de la flora bonaerense. Boletín de la Sociedad Argentina de Botánica, 22 (1-4), 237-253.
Canalli, Y. M. y Bove, C. P. (2017). Flora of Rio de Janeiro: Alismataceae. Rodriguésia, 68, 17–28.
Chanda, S., Nilsson S. y Blackmore, S. (1988). Phylogenetic trends in the Alismatales with reference to pollen grains, Grana, 27 (4), 257-272. https://doi.org/10.1080/ 00173138809429948.
Chen, L. Y., Chen, J. M., Gituru, R. W., Temam, T. D. y Wang, Q. F. (2012). Generic phylogeny and historical biogeography of Alismataceae, inferred from multiple DNA sequences. Molecular Phylogenetics and Evolution, 63, 407–416.
Chen, L. Y., Chen, J. M., Gituru, R. W. y Wang, Q. F. (2013). Eurasian origin of Alismatidae inferred from statistical dispersal–vicariance analysis. Molecular phylogenetics and evolution, 67 (1), 38-42.
Coiffard, C. y Mohr, B. A. R. (2018). Cretaceous tropical Alismatales in Africa: diversity, climate and evolution. Botanical Journal of the Linnean Society, 188, 117–131.
Colinvaux, P. A., Bush, M. B., Steinitz-Kannan, M. y Miller, M. C. (1997). Glacial and postglacial pollen records from the Ecuadorian Andes and Amazon. Quaternary research, 48 (1), 69-78.
Couper, R. A. (1960). New Zealand Mesozoic and Cainozoic plant microfossils. New Zealand Geological Survey Paleontological Bulletin, 32, 1-87.
Daghlian, C. P. (1981). A review of the fossil record of monocotyledons. The Botanical Review, 47, 517–555.
D’Apolito, C., da Silva-Caminha, S. A., Jaramillo, C., Dino, R.. y Soares, E. A. (2018). The Pliocene–Pleistocene palynology of the Negro River, Brazil. Palynology, 43 (2), 223-243. https://doi.org/10.1080/01916122.2018.1437090.
D’Apolito, C., Silva-Camina, S. A. F. y Jaramillo, C. (2024). Palynology of core 1-AS-20-AM from the Miocene and Quaternary of western Amazonia. Acta Paleobotánica, 64, 310-334.
Evaldt, A. C. P., Bauermann, S. G. y Souza, P. A. (2013). Palinomorfos holocênicos de um fragmento de Savana Estépica Parque, Barra do Quaraí, Rio Grande do Sul, Brasil. Pesquisas em Geociências, 40, 209-232.
Evaldt, A. C. P., Bauermann, S. G. y Sousa, P. A. (2014). Registros polínicos para Holoceno Tardio da Região Campanha (Rio Grande do Sul, Brasil), e seu significado na História dos paleoambientes da savana estépica parque. Revista brasileira de paleontologia, 17 (2), 183-194.
Friis, E. M., Crane, P. R.y Pedersen, P. R. (2011). Fossils of monocots en Friis, E. M., Crane, P. R.y Pedersen, P. R. (Eds.), Early flowers and Angiosperm evolution (1 ed, pp. 249-274) Cambridge University Press.
Galli, C. I., Ramírez, A., Barrientos, C., Reynolds, J., Viramonte, J. G., y Idleman, B. (2008). Estudio de proveniencia de los depósitos del Grupo Payogastilla (Mioceno Medio-Superior) aflorantes en el río Calchaquí, provincia de Salta, Argentina. Congreso Geológico Argentino. Jujuy, Actas 17 (1), 353-354.
Galli, C. I., Anzótegui, L. M., Horn, M. Y. y Morton, L. S. (2011). Paleoambiente y paleocomunidades de la formación Palo Pintado (Mioceno-Plioceno), Provincia de Salta, Argentina. Revista mexicana de ciencias geológicas, 28 (1), 161-174.
Galli, C. I., Coira, B., Alonso, R., Reynolds, J., Matteini, M., y Hauser, N. (2014). Tectonic controls on the evolution of the Andean Cenozoic foreland basin: Evidence from fluvial system variations in the Payogastilla Group, in the Calchaquí, Tonco and Amblayo Valleys, NW Argentina. Journal of South American Earth Sciences, 52, 234-259.
García Murcia, Y., Rangel, J. O. y Fernández, D. (2011). Palynological flora of the wetland from the aquatic, swamp and floodplain vegetation of the Córdoba and Cesar departments (Colombian Caribbean). Caldasia, 33 (2), 573-618.
Garralla, S., Anzótegui, L. y Mautino, L. R. (2016). Relaciones paleoflorísticas del Mio-Plioceno del Norte argentino. Publicación electrónica de la Asociación paleontológica argentina, 16 (1), 1-13. https://doi.org/10.5710/PEAPA.29.02.2016.89.
GBIF.org (marzo de 2024). Alismataceae. Global Biodiversity Information Facility. https://www.gbif.org/es/species/search?q=Alismataceae.
Grill, S. C. (1997). Palinología de un perfil Cuaternario en el valle de Napostá Grande, Buenos Aires, Argentina. Polen, 8, 25-42.
Gutiérrez, M. A., Martínez, G. A., Luchsinger, H., Grill, S., Zucol, A. F., Hassan, G. S., Barros, M. P., Kaufmann, C. A. y Álvarez, M. C. (2011). Paleoenvironments in the Paso Otero locality during late Pleistocene–Holocene (Pampean region, Argentina): an interdisciplinary approach. Quaternary International, 245, 37–47.
Halbritter, H. (marzo de 2021). Echinodorus uruguayensis. PalDat - A palynological database. https://www.paldat.org/pub/Echinodorus_uruguayensis/301405.
Halbritter, H. y Weis, B. (marzo de 2021). Echinodorus cordifolius. PalDat - A palynological database. https://www.paldat.org/pub/Echinodorus-cordifolius/303026
Hammen T. y Wymstra, T. A. (1964). Palynological study of the Tertiary and upper Cretaceous of British Guiana. Leidse Geologische Mededelingen, 30 (1), 183-241.
Haynes, R.. R. y Holm-Nielsen, L. B. (1994). The Alismataceae. Flora Neotropica, 64, 1–112.
Hernández‐Sandoval, L., Cevallos‐Ferriz, S. R. y Hernández‐Damián, A. L. (2023). Nichima gen. nov. (Alismataceae) based on reproductive structures from the Oligocene‐Miocene of Mexico. American Journal of Botany, 110 (10), VER 1. https://doi.org/10.1002/ajb2.16231.
Herngreen, G. F. W. (1973). Palynology of Albian-Cenomanian strata of borehole 1-QS-1-MA, State of Maranhão, Brazil. Pollen et Spores, 15, 155-555.
Hesse, M., Halbritter, H., Zetter, R., Weber, M., Buchner, R., Frosch-Radivo, A. y Ulrich, S. (2009). Pollen Terminology An illustrated handbook. Springer open.
Hooghiemstra, H. (1984). Vegetational and Climatic History of the High Plain of Bogotá, Colombia: a continuous record of the last 3,5 million years. Dissertationes Botanicae, 79, 1-368.
Horn, M. Y. (2014). Palinofloras de las formaciones El Morterito y Palo Pintado (Mioceno Superior-Plioceno Inferior), Noroeste de Argentina. [Tesis Doctoral].
Ibrahim, M. I. A., Zobaa, M. K., El–Noamani Z. M. y Tahoun, S. S. (2015). A review of the angiosperm pollen genus Cretacaeiporites Herngreen, with one new species from the Upper Cretaceous of Egypt, Palynology. https://doi.org/10.1080/01916122.2015.1093561.
Ito, Y., N. Tanaka, B. R., Keener y Lehtonen, S. (2020). Phylogeny and biogeography of Sagittaria (Alismataceae) revisited: evidence for cryptic diversity and colonization out of South America. Journal of Plant research, 133 (6), 827-839.
Jansonius, J. y Hill, L. V. (1998). Genera file of fossil spores and pollen. Special Publication, Department of Geology, University of Calgary.
Jérémie, J., Lobreau-Callen, D., Couderc, H. y Jossang, A. (2001). Une nouvelle espèce d’Echinodorus (Alismataceae) de Guadeloupe (Petites Antilles). Observations palynologiques, cytogénétiques et chimiques. Adansonia, 23 (2), 191-203.
Kedves, M. (1981). Études palynologiques sur les sédiments préquaternaires de l’Egypte. Néogène I, Grana, 20 (2), 119-130.
Krutzsch, W. (1966). Zur Kenntnis des präquartaren periporaten Pollenformen. Geologie Berlín. 15 (55), 16-71.
Lehtonen, S. (2018). Alismataceae. En Ramella, L. (Ed.), Flora del Paraguay (Vol. 49, pp. 1–48). Conservatoire et Jardin botaniques de la Ville de Genève.
Li, Z., Lehtonen, S., Martins, K., Wang, Q. F. y Chen., J. M. (2022). Complete genus‐level plastid phylogenomics of Alismataceae with revisited historical biogeography. Molecular Phylogenetics and Evolution, 166, 107334.
Martínez Hernández, E. y Ramírez Arriaga, E. (1999). Palinoestratigrafía de la región de Tepexi, Puebla, México. Implicancias cronoestratigráficas. Revista Mexicana de Ciencias Geológicas, 16 (2), 187-207.
Mautino, L. R. (2007). Chlorophyta de los valles Calchaquíes (Mioceno medio y superior) Argentina. Revista española de Micropaleontología, 39 (1-2), 81-102.
Mautino, L. R. y Garralla, S. S. (2021). Polen fósil afín a Pontederia L., Gleditsia L. y Parkinsonia L., Mioceno de Salta, Argentina. Primeros registros para Sudamérica. Publicación electrónica de la Asociación paleontológica Argentina, 21 (1), 1-17. https://dx.doi.org/10.5710/PEAPA.15.10.2020.333.
Mautino, L. R., Farrell, E. E y Palazzesi, L. (30 noviembre-3 diciembre 2021). Polen fósil con afinidad a Alismataceae, Formación Palo Pintado, Mioceno de Argentina [resumen de presentación]. VI Simposio del Mioceno Pleistoceno del Centro y Norte de Argentina. Buenos Aires.
Mendez, L.A. S., Meneses, M. E. N. S., Behling, H. y Costa, L.M. (2021). Modern and fossil pollen record from region of the middle Araguaia River floodplain, Tocantins State (Brazil). Pesquisas em Geociências, 48 (4), e111397. https://doi.org/10.22456/1807-9806.111397.
Muller, J. (1981). Fossil pollen records of extant angiosperms. The Botanical Review, 47, 1–142.
Passarelli, L. M. y Cortés, R. M. (2017). Pollen as a Forensic Tool in a Zone of Wetlands from Buenos Aires, Argentina. Journal of Forensic Research, 8, 366. https://doi:10.4172/2157-7145.1000366.
Potonié, R. (1960). Synopsis der Gattungen der Sporae Dispersae. 3. Teil: Nachträge Sporites, Fortsetzung Pollenites. Beihefte zum Geologischen Jahrbuch, 39, 1-189.
Punt, W. y Reumer, J. W. (1981). Alismataceae. Review of Palaeobotany and Palynology, 33, 27-44.
Punt, W., Hoen, P. P., Blackmore, S., Nilsson, S. y Le Thomas, A. (2007). Glossary of pollen and spore terminology. Review of Palaeobotany and Palynology, 143, 1-81.
Raatz, G. V. (1937). Mikrobotanisch-stratigraphische Untersuchung der Braunkohle des Muskauer bogens. Abhandlungen der Königlich Preussischen Geologischen Landesanstalt, 183.
Radaeski, J. N., Evaldt, A. C. P., y Bauermann, S. G. (2014). Grãos de pólen de espécies ocorrentes na unidade de conservação parque estadual do Espinilho, Barra do Quaraí, Rio Grande do Sul, Brasil. Pesquisas, Botânica, 65, 305-332.
Robledo, J. M., Horn, Y. M., Galli, C. I. y Anzótegui, L. M. (2020). Inferencias paleoclimáticas para el Mioceno tardío en la cuenca de Angastaco basadas en el análisis fisionómico foliar: Formación Palo Pintado, Salta, Argentina. Andean Geology, 47, 418–429.
Robledo, J. M., Contreras, S. A., Baez, J. S. y Galli, C. (2021). First Miocene megafossil of arrowhead, alismataceous plant Sagittaria, from South America. Acta Palaeontologica Polonica, 66 (3), 111-122. https://doi.org/10.4202/app.00835.2020.
Roubik, D. W. y Moreno, P. J. E. (1991). Pollen and spores of Barro Colorado Island [Panamá]. Missouri Botanical Garden.
Salamanca Villegas, S., van Soelen, E. E., Teunissen van Manen, M. L., Flantua, S. G., Santos, R. V., Roddaz, M., Dantas, E. L., van Loon, E., Sinninghe Damste, J. S., Kim, J-H y Hoorn, C. (2016). Amazon forest dynamics under changing abiotic conditions in the early Miocene (Colombian Amazonia). Journal of Biogeography, 43 (12), 2424-2437.
Sá, N. P. y Carvalho, M. A. (2017). Miocene fern spores and pollen grains from the Solimões Basin, Amazon Region, Brazil. Acta Botanica Brasilica, 31 (4), 720-735.
Salgado, C. (2006). Flora melífera en la provincia del Chaco. Gobierno de la provincia del Chaco. Ministerio de la Producción del Chaco, PROSAP.
Salgado, C. (2015). Caracterización botánica y geográfica de las mieles producidas por Apis mellifera L. en la provincia del Chaco, a partir de su composición polínica y parámetros físico-químicos. [Tesis doctoral].
Stevens, P. F. (marzo de 2021). Alismataceae. Angiosperm Phylogeny Website. https://www.mobot.org/mobot/research/APweb/.
Stover, L., E. y Partridge, A. D. (1973). Tertiary and Late Cretaceous spores and pollen from the Gippsland Basin, Southeastern Australia. Proceedings of the Royal Society of Victoria, 85, 237-286.
Thomson, P. W. y Pflug, H. (1953). Pollen und sporen des mitteleuropäischen Tertiärs. Palaeontographica, 94, 1-138.
Torres, G., Lupo, L. y Pérez, C. (2022). Reconstruction of the environmental conditions for the past 2,000 years in the Perico River basin (NW Argentina) based on fossil pollen records. Vegetation History and Archaeobotany, 32 (3), 235-251. https://doi.org/10.1007/s00334-022-00900-2.
Tur, N. M. (2008). Alismataceae en Hurrel J. A. (Ed.), Flora Rioplatense. Sistemática, ecología y etnobotánica de las plantas vasculares rioplatenses. Parte 3 Monocotiledóneas. (Vol. 1, pp 21-38). Editorial. L.O.L.A.
Villagrán, C. (1991). Historia de los bosques templados del sur de Chile durante el Tardiglacial y Postglacial History of the temperate forests of southern Chile during the Late-Glacial and Holocene. Revista Chilena de Historia Natural, 64, 447-460.
Villagrán, C., León, A. y Roig, F. A. (2004). Paleodistribución del alerce y ciprés de las Guaitecas durante períodos interestadiales de la Glaciación Llanquihue: provincias de Llanquihue y Chiloé, Región de Los Lagos, Chile. Revista geológica de Chile, 31 (1), 133-151.
White, J.M. (2021). Palynodata Datafile: 2006 versión. https://paleobotany.ru/palynodata.
Ybert, J. P., Bove, C. P. y de Araujo Carvalho, M. (2017). Esporos e grãos de pólen de plantas aquáticas da planície costeira do sudeste do Brasil. Museu Nacional- Série Livros Digital 7.
Wodehouse, R. P. (1936). Pollen grains in the identification and classification of plants. VIII. The Alismataceae. American Journal of Botany, 535-539.